4. El desarrollo tecnológico. Sus aplicaciones.
Las exigencias de la sociedad industrial del siglo XXI están
estimulando la búsqueda de nuevos materiales llamados a revolucionar nuestras
vidas en el futuro.
Las cerámicas constituyen el mejor ejemplo de materiales que
han dado a los investigadores muchas más
decepciones que alegrías. Se trata de
materiales fáciles de moldear que tras ser sometidos a cocción adquieren una
gran dureza y resistencia al calor.

Las arcillas son los materiales cerámicos
por excelencia. Por su capacidad para soportar altas temperaturas son
utilizados en circuitos electrónicos, pero la fragilidad de las cerámicas
aplicadas al mundo del motor sigue siendo un problema insuperable. Ningún motor
cerámico ha sido capaz de pasar a la fase de producción en masa.

La industria aeronáutica es una de las principales
demandantes de nuevos materiales. Metales como el titanio fueron esenciales
para construir los primeros aviones supersónicos. En la actualidad están
cobrando una importancia cada vez los materiales compuestos ( COMPOSITES),
llamados así porque resultan de la combinación
de dos o más materiales que dan
como resultado un material nuevo, esta peculiaridad es conocida en ingeniería
con el nombre de sinergia.
Buena parte del esfuerzo de investigación en nuevos
materiales está siendo orientado al desarrollo de composites a partir de
diferentes tipos de polímeros. La famosa fibra de carbono es un material compuesto que se sintetiza a partir de un polímero tipo fibra
llamado poliacrilonitilo y un polímero adhesivo, usualmente resina epoxi.
4.1. Moléculas a la carta: fullerenos y nanotubos.
El carbono es uno de los elementos más abundantes del
planeta y componente básico de la química de la vida. Existe una propiedad
natural llamada alotropía, que consiste en que un mismo elemento o compuesto
puede presentar propiedades diferentes según la disposición de sus átomos o
moléculas, las dos más abundantes son el O2 y el O3.
El carbono presenta dos formas alotrópicas en la naturaleza: la más común es el
grafito, con el que se hace la mina de los lápices; la más rara y
apreciada es el diamante, que se caracteriza porque los átomos de carbono
forman una estructura cristalina que le confiere una dureza extraordinaria.

En el año 1985 era descubierta por casualidad una molécula
que fue llamada inicialmente futboleno, pues su forma recordaba a la de un
balón de futbol; pronto fue conocida como buckminster fullereno porque su
estructura molecular tiene una forma semejante a la de la cúpula geodésica
diseñada en los años 60 por Richard buckminster fuller, denominadas bajo el
nombre genérico de fullerenos.

Pronto quedaron en evidencia algunas de sus propiedades: se
pueden polemizar, se pueden inscribir uno dentro de otro y es posible sustituir
alguno de sus átomos de carbono por los de otros elementos, obteniendo los
llamados heterofullerenos. Se intentan tener los mismos resultados Con los
pseudofullerenos, moléculas con estructuras semejantes a las de los fullerenos
pero obtenidas a parir de otras sustancias químicas como el nitruro de boro, el
sulfuro de tungsteno o el sulfuro de molibdeno.
Los fullerenos no tienen aplicaciones prácticas en la actualidad, pero buena prueba
de su potencial es el gran número
de patentes que si han registrado en relación con estas moléculas.
Las facultades del carbono no acaban ahí. Si se
eliminan os enlaces que establecen
pentágonos únicamente dejamos los que dan lugar a a hexágonos, el carbono no
forma fullerenos. Esto se debe a que la molécula no llega a cerrarse sobre sí
misma, sino que forma una lámina parecida a un panal de abeja, que puede
enrollarse derivando en los llamados nanotubos.
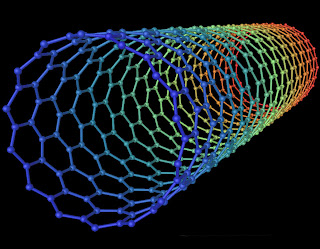
Con nanotubos podrían
levantarse estructuras virtualmente indestructibles.
No hay comentarios:
Publicar un comentario